近日,优牙生物首席科学家叶青松教授团队在SCI杂志发表综述性文章《阿尔茨海默病:病理生理学与牙髓干细胞的治疗前景》。

阿尔茨海默病 (AD)
是一种高度危害健康的疾病,其特征是逐渐丧失大脑神经元而产生认知障碍,目前是全球第七大死因,并正在成为全球的一大死因,到2050年,预计全球将出现1.52亿例。
AD患者在死亡前长期处于痴呆状态,严重依赖他人及社会公共卫生资源的照顾。
全球每年用于痴呆症医疗保健的支出高达1万亿美元,因此,AD已被世界卫生组织确定为全球公共卫生优先事项。
世界卫生组织研究报告指出:除了年龄等固有风险因素无法改变外,其他风险因素可通过如体育活动、健康饮食和社交活动等降低患病风险。
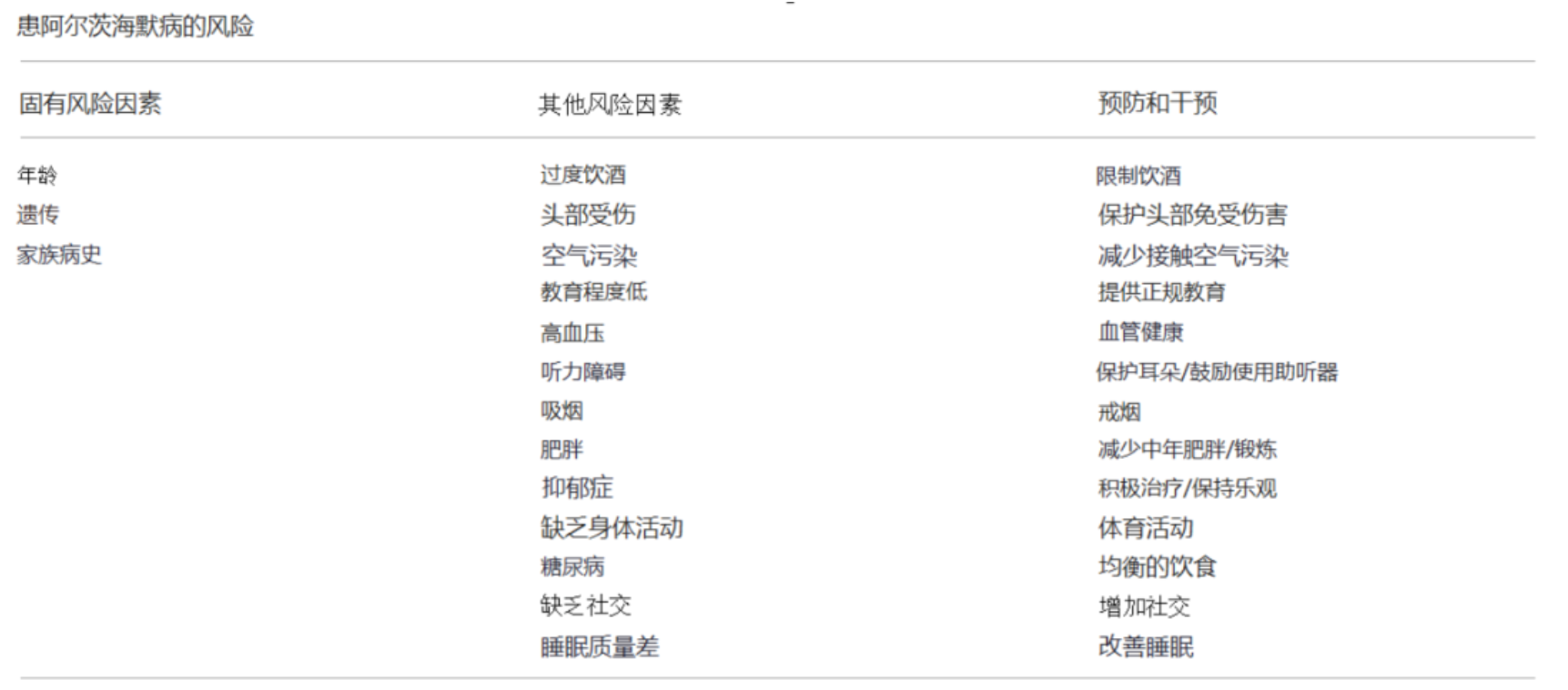
尽管年龄、遗传、家族史和一些危险因素会让人患上AD,但直到目前为止,它的病因仍未明确。
越来越多的人认为AD的发生与其他神经退行性疾病有一些类似的分子机制,包括异常折叠蛋白的过度积累和过度激活的小胶质细胞产生的神经毒性物质。
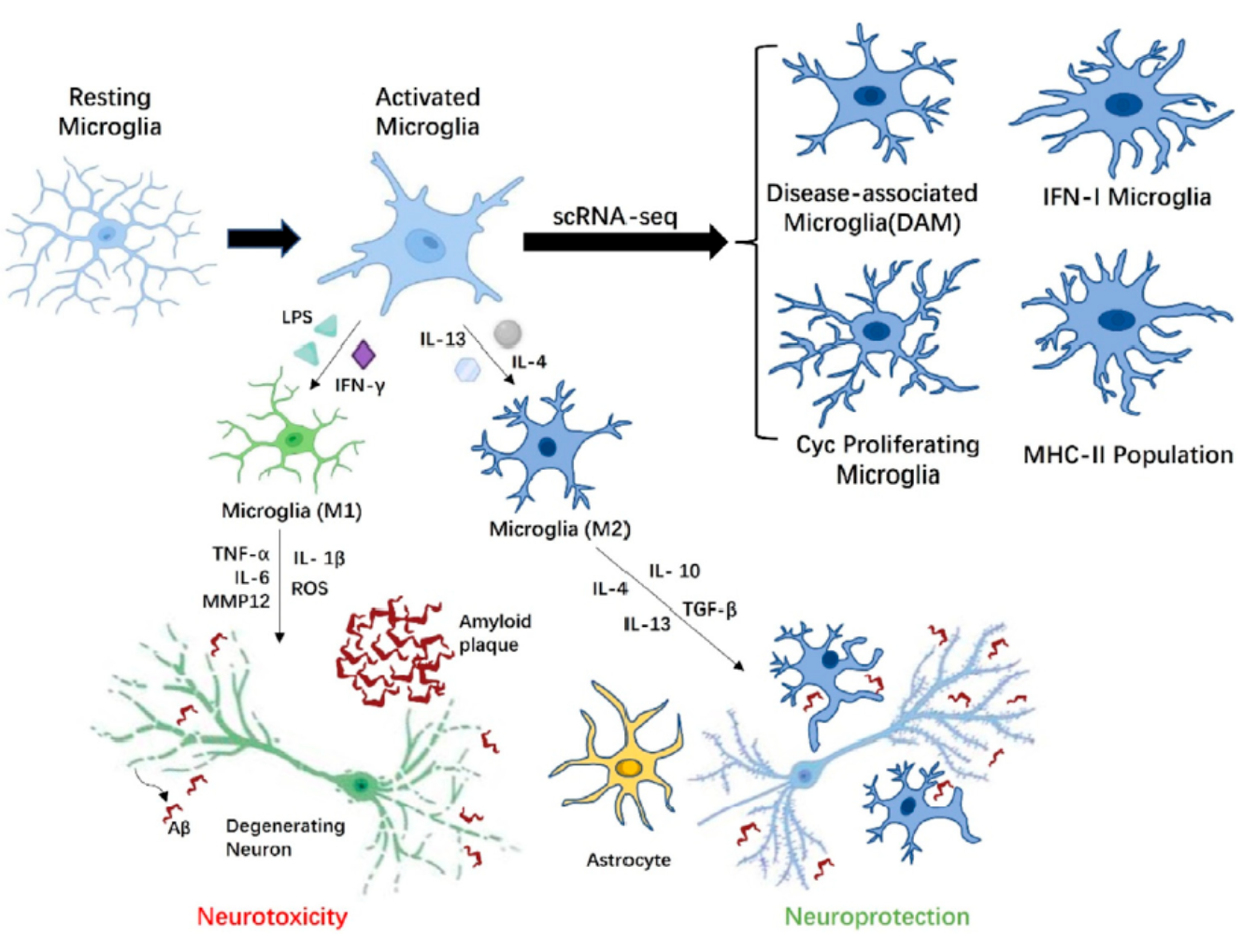
不同表型的小胶质细胞参与AD相关的病理活动。根据AD微环境的刺激,静息小胶质细胞可转化为具有神经毒性的M1型小胶质细胞或M2型小胶质细胞。小胶质细胞和神经保护。在β淀粉样蛋白(Aß)斑块的影响下,激活的M1小胶质细胞过度产生促炎细胞因子(IL-1B)。IL-6和TNF-a),它们对神经元有毒性作用。M2小胶质细胞参与调节抗炎介质(TGF-B)的释放。IL-4和IL-10),从而减少炎症。M2小胶质细胞还通过吞噬作用清除Aß肽,最大限度地限制了Aß肽对邻近神经泌的损伤。小胶质细胞可通过星形胶质细胞间接影响神经元活性。最后,scRNA-seq结果表明,小胶质细胞的多种激活状态与Aß的积累有关,包括位于Aß斑块附近的疾病相关小胶质细胞(DAM)、Cyc增殖小胶质细胞、IFN-I小胶质细胞和MHC-II群体。
尽管从病理生理学角度探索出许多线索,但目前仍缺乏有效的候选药物来延缓或预防疾病的进展。考虑到中枢神经系统再生能力有限以及目前神经损伤不可逆性的现状,科学家希望通过移植外源性干细胞替代中枢神经系统中功能不全的神经细胞来进行干预。
干细胞疗法是AD研究的全球热点
近年来,科学家发现干细胞可以向特定谱系分化,刺激原位神经发生,并分泌多种调节因子,这一革命性发现暗示它们可能补充AD进展中破坏的神经元,并调节受影响的微环境。同样,干细胞示踪剂和3D生物打印技术的出现和蓬勃发展,也为干细胞治疗AD开创了新的时代。
一般来说,通常用于AD研究的干细胞有三种,包括胚胎干细胞(ESCs)、诱导多能干细胞(iPSCs)和间充质干细胞(MSCs)。然而,部分干细胞可塑性低,不稳定,以及有伦理问题,是干细胞疗法研究难点所在。
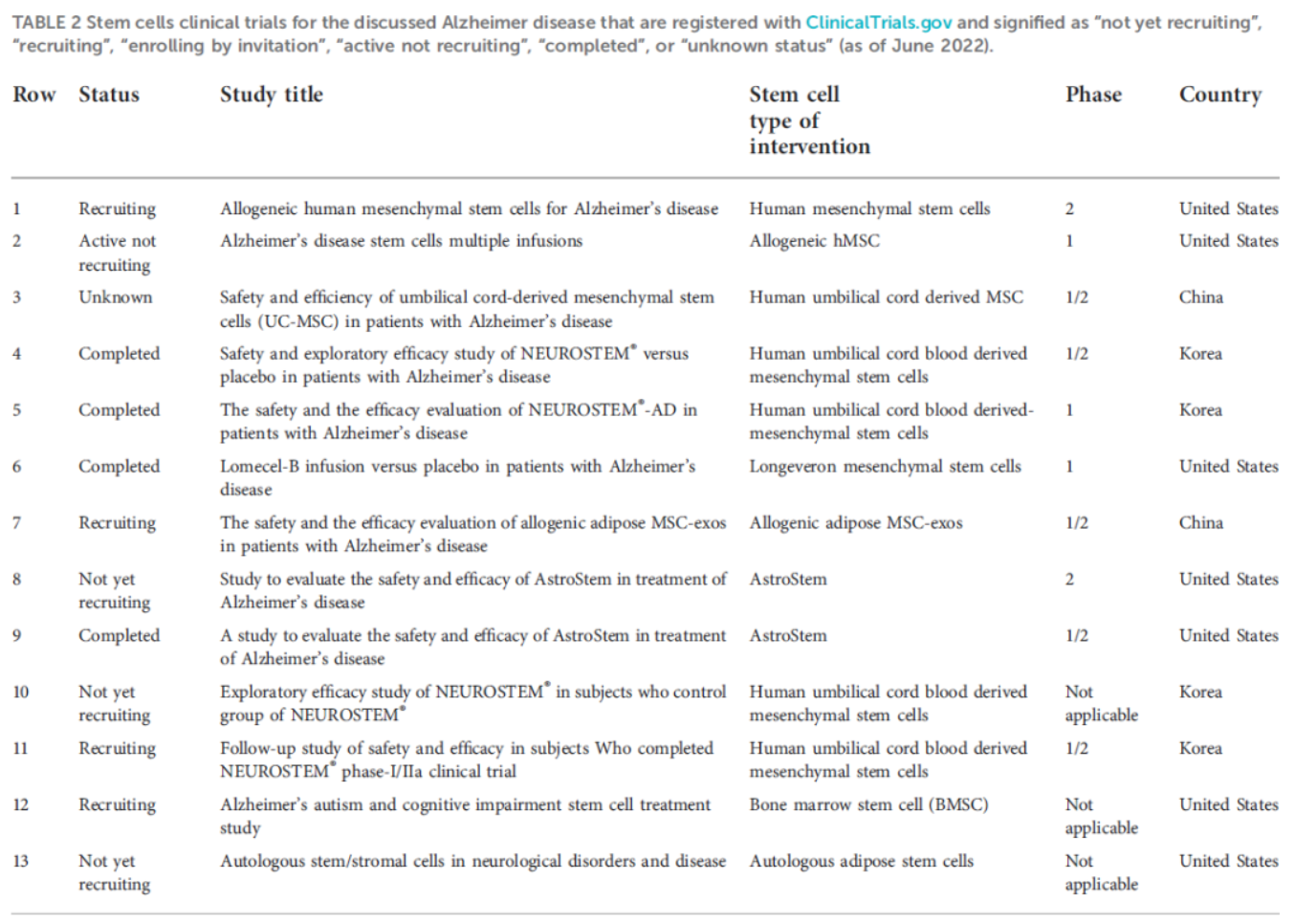
截至2022年6月,在国际临床试验注册中心ClinicalTrials.gov查询:全球治疗AD的干细胞临床试验有13项,其中:中国2项,美国7项,韩国4项,他们多数使用了间充质干细胞。
牙髓干细胞带来新希望
在这里,我们讨论一种更容易获得的间充质干细胞:牙髓间充质干细胞(DPSCs)。
它通过废弃牙齿提取,不需要额外的侵入性手术采集,因此伦理争议小。在适当的诱导培养基条件下,DPSCs具有多谱系分化和表达各自基因标记物的能力。
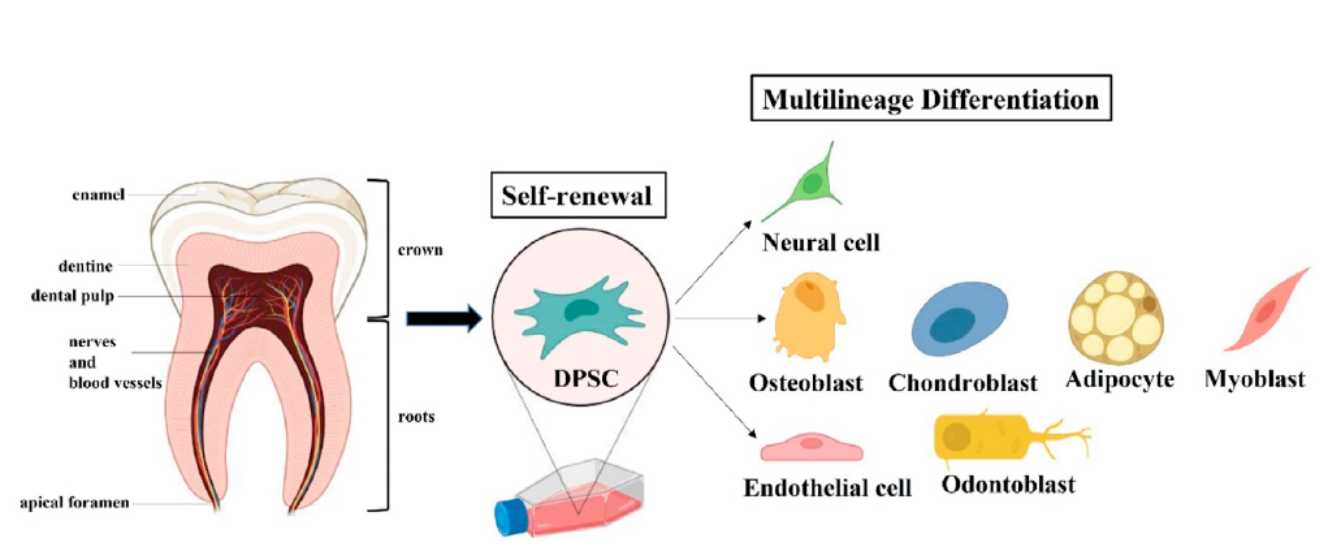
体外研究表明:与骨髓间充质干细胞(BMMSCs)和脂肪细胞干细胞(ASCs)相比,DPSCs具有明显更高的增殖和分化能力。此外,它还表现出与胚胎干细胞(ESCs)相关的标记,这在其他类型的间充质干细胞中是罕见的。
基于这些原因,科学家正在利用DPSCs开发脑部类器官,以更好地探索AD发病机制和体外治疗模型。特别值得注意的是,低温保存可以储存整颗牙齿或DPSCs,这是逐步实现长期临床使用的一个重要考虑因素。
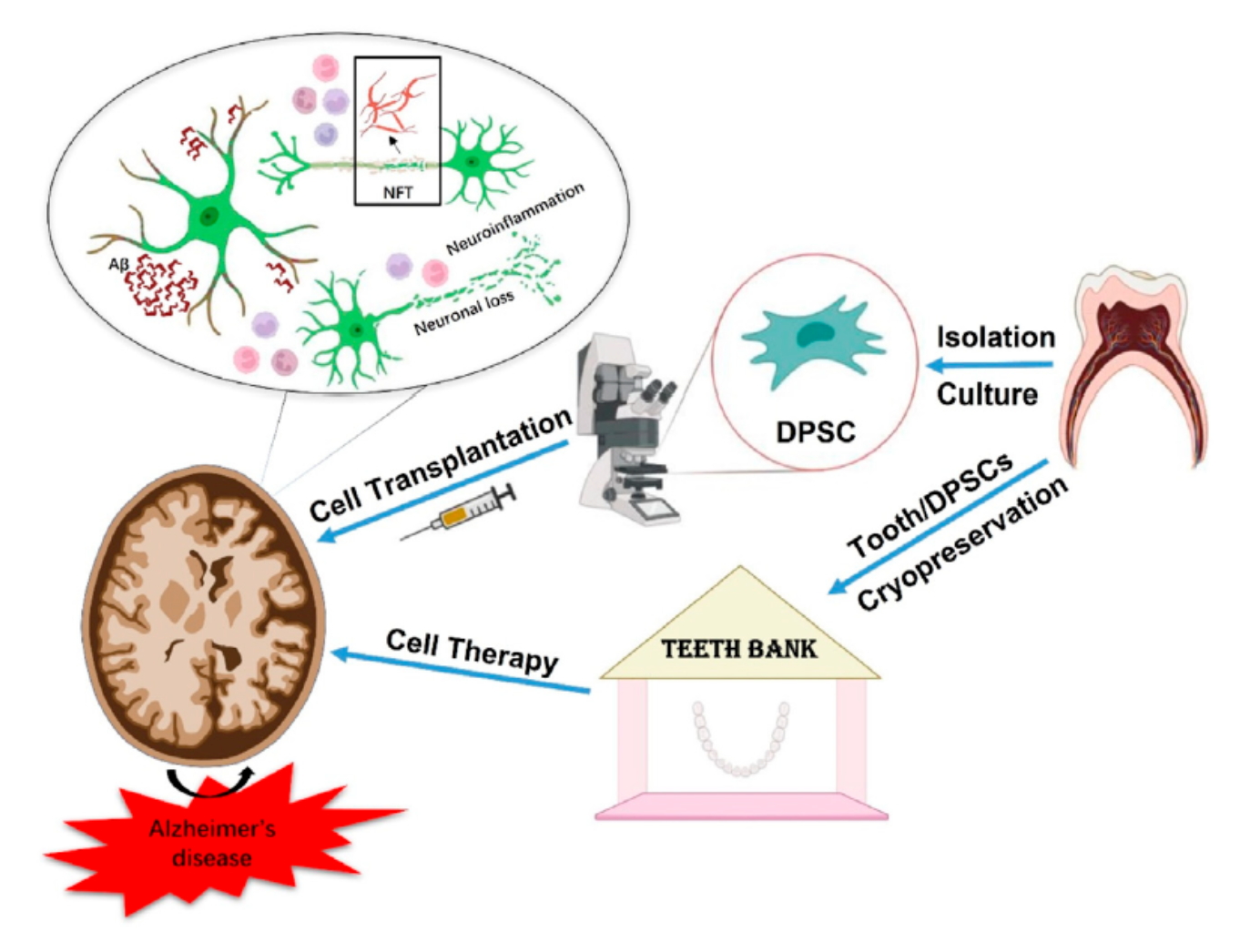
研究表明:低温保存后DPSCs仍然可以保持生物学特性,依然具备非凡的增殖和分化能力。
近年来,许多国家都建立(GMP)级牙齿干细胞库,储存DPSCs以备不时之需,这为其作为自体干细胞移植治疗AD提供了便利。
在特定的微环境中移植外源性干细胞成为治疗AD的有前途的策略之一,与其他类型的干细胞相比,DPSCs保留了源于颅神经嵴细胞的神经元分化特性,因此它们在体外和体内向神经元诱导分化。
近年来,已有多种DPSCs的体外神经元分化方案被研发。首先,值得一提的是Pisciotta等人2018年构建的3D漂浮球培养系统,该系统可以维持DPSCs的神经相关特性。一些更有趣的研究是利用神经球的形成来促进DPSCs的神经源性成熟。Gervois等人2015年首次描述了由DPSCs衍生的神经球内微环境的结构数据,但结果显示,分化后的DPSCs明显表达神经元和突触标记物,改善了相邻细胞间的通讯网络,并部分分化为功能神经元。
2014年,Kanafi et al.证实sonic hedgehog基因(SHH)、成纤维细胞生长因子8 (FGF8)和碱性成纤维细胞生长因子(bFGF)共同培养DPSCs时,DPSCs可以向功能性多巴胺能神经元分化,而且还能组成性地分泌多巴胺。这些数据显示,DPSCs对神经元微环境保持了良好的神经可塑性,使其成为一种新型容易获得,并在体内可整合的种子细胞。
DPSCs还能发挥重要的免疫调控作用,已被证明具有特殊的免疫调节和免疫抑制特性,特别是下调T细胞、树突状细胞(DC)、NK细胞和B细胞的免疫应答。此外,DPSCs还能显著改变促炎细胞因子的数量以及增加抗炎细胞因子的数量,预防炎症反应。许多体外研究均证实了DPSCs的免疫抑制活性。
DPSCs的外泌体也是治疗AD的关键因素。作者认为,在实验组观察到的神经保护、增强的神经发生和认知性能可能至少部分归因于DPSCs外泌体的作用。
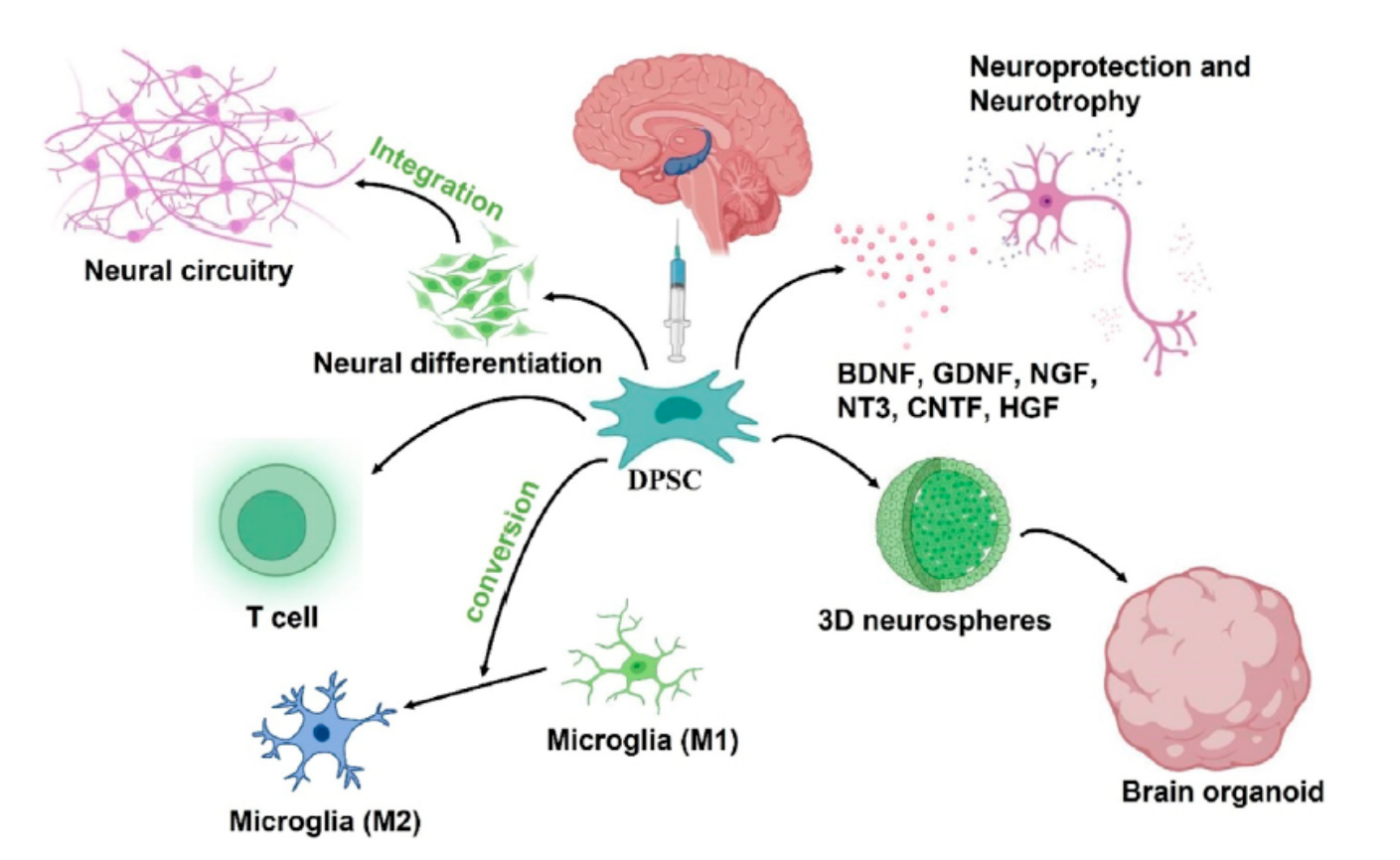
DPSCs治疗AD的作用机制:1)神经分化取代受损神经元,2)分泌神经保护和神经营养因子,3)神经免疫调节。植入的DPSCs将分化成神经细胞,取代AD大脑中受损的神经元,同时融入现有的神经回路。DPSCs移植后还能通过分泌神经保护因子和神经营养因子保护脑内神经元,并驱动巨噬细胞向M2表型极化,调节微环境中的神经炎症。此外,通过神经诱导和3D培养方案,DPSC可以发展成脑类器官,用于体外模拟实验。
综上所述,DPSCs显著的生物学特性将为干细胞疗法在AD中的应用开辟新的途径,本团队也基于过去的研究积累,于2022年成功申报了湖北省重点研发计划。
叶青松教授团队牵头申报
展 望:
阿尔茨海默病(AD)无疑是人类社会面临的重大医疗危机。近年来,尽管基于外源性干细胞的疗法在AD基础研究中取得了巨大进展,然而,利用外源性干细胞治疗AD的主要障碍之一是选择合适的细胞类型,这种细胞要具备伦理争议低、采集方便和神经修复潜力强的特点。
DPSCs通过废弃牙齿采集,在神经修复方面有先天优势,应该是治疗AD的最佳细胞来源。另一方面,经过长期低温保存后,DPSCs仍具备高活性可用于治疗。
随着再生医学和组织工程的快速发展,DPSCs在生长因子和生物材料的加持下,显然能够发挥更强的神经分化和保护特性。此外,利用基因编辑技术改造的干细胞,可优化干细胞治疗的安全性、有效性和个体化治疗策略。
综上所述,干细胞治疗AD并不是一个遥远的目标,DPSCs与生物材料和纳米技术结合应用,能够积极恢复AD患者的受损大脑,十分可行。
参考文献:
https://doi.org/10.3389/fcell.2022.999024
